Потенциометрия.
Метод электрохимического анализа ионного состава сред, основанный на измерении ЭДС гальванического элемента, состоящего из измерительного электрода и электрода сравнения. Потенциал измерительного электрода зависит от состава раствора, а потенциал электрода сравнения постоянен. Эти электроды могут быть совмещены в едином устройстве, которое получило название "комбинированный электрод".
Измерительные электроды.
Представляют собой корпус, с одной стороны которого установлена (вклеена или впаяна) чувствительная мембрана, а с другой имеется разъем или кабель с разъемом для подключения к измерительному прибору.
Измерительные электроды могут классифицироваться по следующим критериям.
По назначению:
По типу (материалу) мембраны:
По устройству токоотвода от чувствительной мембраны:
Электроды сравнения.
Представляют собой полый корпус, заполненный электролитом, в который помещен потенциалообразующий полуэлемент. С одной стороны в корпусе имеется пористая мембрана, которая обеспечивает жидкостной контакт между электролитом в электроде и анализируемым раствором, но при этом препятствует существенному их взаимопроникновению. А с другой имеется разъем или кабель с разъемом для подключения электрода к измерительному прибору.
Обычно электроды сравнения классифицируются по электрохимической системе, на основе которой выполнен их потециалоопределяющий полуэлемент. Наиболее известными являются:
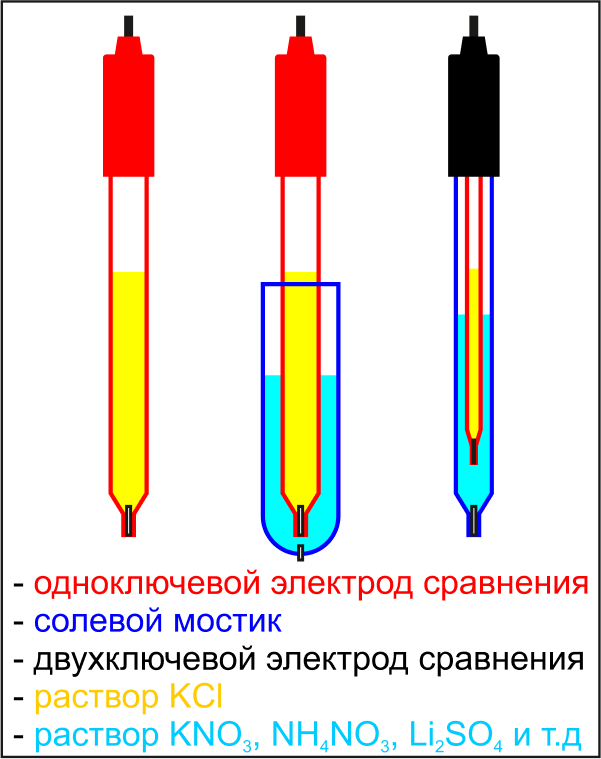
Кроме того, электроды сравнения бывают одноключевыми и двухключевыми. Конструкция одноключевого электрода сравнения описана в начале статьи. Такие электроды могут заполняться только тем электролитом, который необходим для работы его полуэлемента. Для хлорсеребряного электрода это раствор KCI.
Однако, в некоторых случаях раствор KCI применяться не может. Например, при определении ионов K+ или CI-, электролит из электрода сравнения, проникая через пористую мембрану в анализируемый раствор, может изменить их концентрацию. Аналогичная ситуация возникает при анализе ионов, которые взаимодействуют с ионами CI-, образуя малорастворимые соединения, например, AG+• и Рb2+ И даже в тех случаях, когда они не являются объектом анализа, а только присутствуют в анализируемом растворе, то и тогда использовать раствор KCI нельзя, т.к. выпадающие соединения могут забить пористую мембрану, и электрод выйдет из строя. В таких случаях используют или одноключевые электроды с внешним солевым мостиком, который представляет собой емкость с пористой мембраной. Или двухключевые электроды сравнения, у которых такой мостик встроен уже в конструкцию. Мостик заполняется индифферентным электролитом, рекомендуемы для каждого вида анализа.
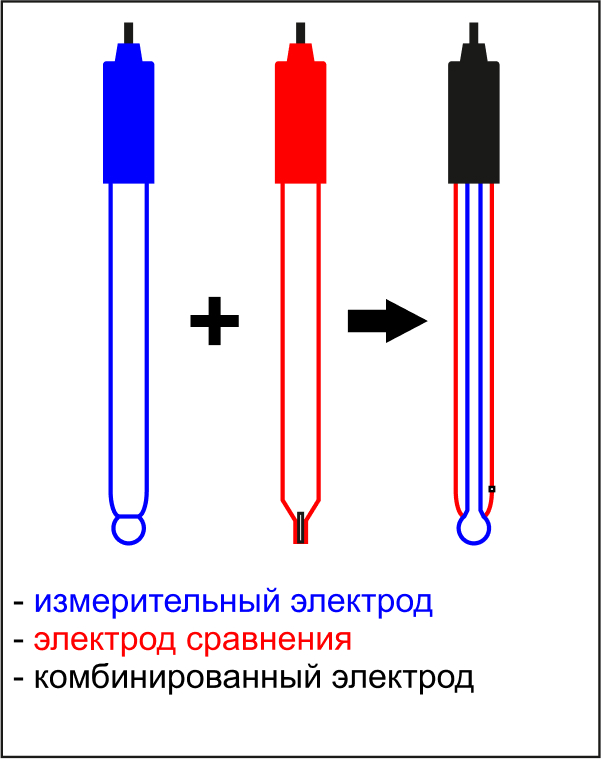
Комбинированные электроды.
Датчики, в которых измерительный электрод и электрод сравнения совмещены в едином корпусе. В большинстве случаев комбинированные электроды в эксплуатации более удобны, чем раздельная электродная пара. Они выпускаются во множестве модификаций, что позволяет подобрать оптимальный вариант для различных конкретных условий применения.
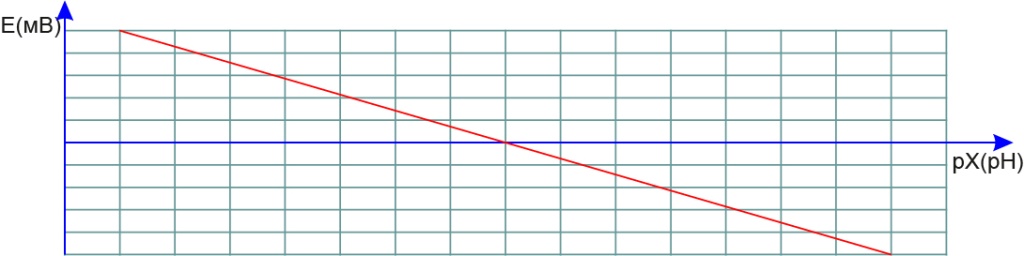
Электродная характеристика.
Это зависимость ЭДС электродной системы от концентрации (активности*) определяемых ионов в растворе. Она подчиняется уравнению Нернста и представляет собой прямую линию в координатах E-,-(-l gC). Для упрощения записи используют обозначение рХ (рХ= -lgC) для любых ионов. Данная величина носит название показатель концентрации (активности*) ионов в растворе. Для конкретных ионов в ее записи приводится символ, соответствующий этому иону. Например, для ионов водорода - рН, для нитрат-ионов - рNО, и т.д.
Крутизна электродной характеристики.
Это изменение ЭДС электродной системы при изменении концентрации определяемых ионов в 1О раз (мВ/рХ). Обозначается буквой S (от английского slope - наклон). Крутизна электродной характеристики зависит от температуры, а ее теоретическое значение рассчитывается по формуле: S=2,ЗRT/nF где:
У реальных электродов крутизна характеристики всегда несколько меньше теоретической.
Изоnотенциальная точка.
Это точка, в которой пересекаются электродные характеристики для разных температур. Она имеет координаты pXi и Ei.
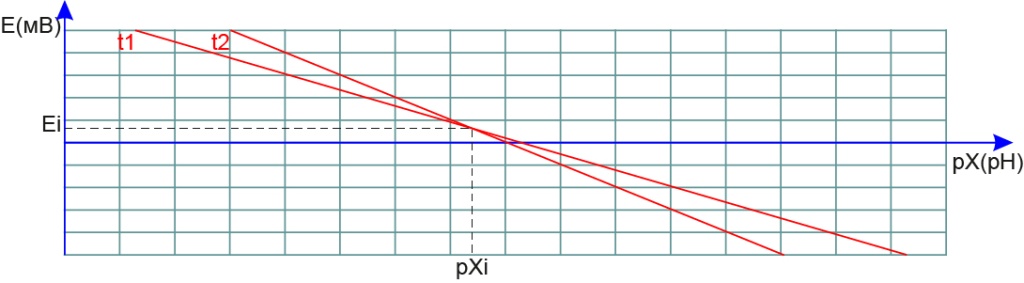
Координаты изопотенциальной точки нормируются только для стеклянных электродов: рН и pNa (но не всех). Они используется измерительным прибором для осуществления термокомпенсации и автоматического распознавания градуировочных растворов. Отечественные электроды по сложившейся традиции выпускаются с разными изопотенциальными точками (около рН 4, 7 и 10). Соответственно и большинство выпускаемых приборов может быть настроено для работы этими электродами. Все импортные электроды имеют pHi=7, а приборы настроены только на это значение.
*В целях упрощения изложения материала понятие активности и ее отличие от концентрации рассматриваться не будут.
Возможность выбора положения изопотенциальной точки позволяет уменьшить погрешность измерений из-за влияния температуры, т.к. в области ее расположения оно наименьшее. В основном это актуально для промышленных применений, когда по каким-то причинам нет возможности использовать автоматическую термокомпенсацию (АТС). Так, например, в эксплуатации находятся еще много промышленных преобразователей, которые имеют ее только в ручном варианте. В этих случаях выбирают электроды с pHi, лежащим в области рН анализируемых растворов. Лабораторные приборы практически все имеют полноценную АТС, поэтому оптимальным вариантом являются электроды с pHi в районе 7. Лабораторные электроды с pHi=4 (4,25) следует выбирать только в том случае, если такое требование приведено в применяемой методике измерений (например, ВНИМИ-03-98).
Измерительный прибор.
В качестве измерительного прибора используются рН-метр или иономер. В основе этих приборов лежит милливольтметр с высоким входным сопротивлением (>1О ТОм). А также имеется аналоговый или цифровой блок преобразования измеренной ЭДС в значение концентрации ионов. Кроме того, в большинстве современных приборов есть канал измерения температуры. Перед выполнением измерений прибор должен быть настроен (отградуирован)для работы с конкретными электродами, рН-метры могут работать только с рН- и редокс-электродами, а иономеры с любыми.
Градуировка.
Настройка прибора для работы с конкретной электродной системой. Выполняется по двум или более растворам известной концентрации. В ходе градуировки производятся измерения ЭДС электродной системы в этих растворах и вводятся значения их концентрации. При этом функция преобразования прибора (ЭДС в рХ) совмещается с электродной характеристикой. После этого прибор может использоваться для анализа.
Термокомпенсация.
Это внесение поправки на температурную зависимость измерительного инструмента (рН-метра или иономера). Крутизна электродной характеристики зависит от температуры. Градуировка прибора осуществляется при какой-то конкретной температуре. При этом крутизна электродной характеристики имеет определенное соответствующее этой температуре значение. Поэтому, если в дальнейшем при выполнении измерений температура растворов изменится, то изменится и крутизна, что приведет к рассогласованию функции преобразования прибора с текущей электродной характеристикой. Если ничего не предпринять, то результаты измерений станут неверными. Приборы с термокомпенсацией способны учесть влияние температуры на электродную систему и скорректировать соответствующим образом свою функцию преобразования. Для этого им нужна информация о текущей температуре раствора и координата pHi изопотенциальной точки. Температура может вводиться вручную (на основании измерений при помощи термометра) или автоматически измеряться прибором при помощи термодатчика. Принцип термокомпенсации заключается в том, что функция преобразования прибора поворачивается на определенный угол вокруг изопотенциальной точки.
Примечание: В общем случае рН раствора изменяется с изменением температуры, поэтому при измерениях с использованием термокомпенсации показания рН-метра также могут изменяться. Довольно распространенное представление о том, что при работе термокомпенсации показания должны быть неизменными, является заблуждением.
Задача организации, в особенности же начало повседневной работы по формированию позиции позволяет оценить значение систем массового участия. Значимость этих проблем настолько очевидна